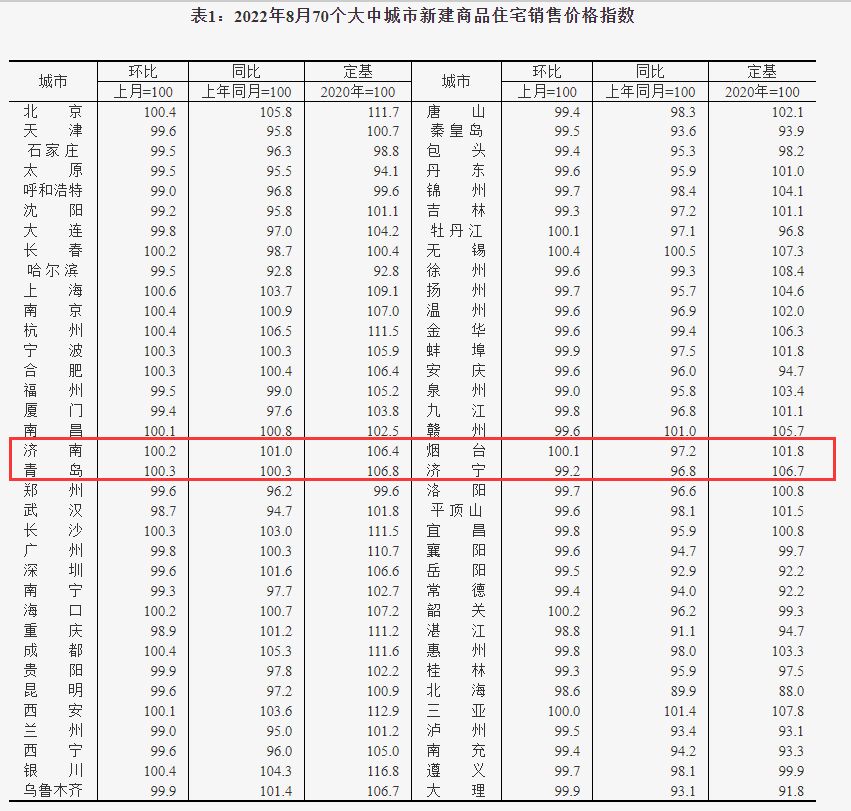
·阿尔茨海默病基因研究先驱鲁道夫·坦齐曾说到,罕见变异在人群中的发生频率低于1%,却占个体基因组变异的77%,仅使用全基因组关联研究(GWAS)可能会错过疾病的大部分遗传景观。
时隔百年,与探究阿尔茨海默病理机制密切相关的两位女性。
 (资料图片)
(资料图片)
逃离阿尔茨海默病的命运
1906年,55岁的奥古斯特·德特女士(Auguste Deter)去世,德国精神病学家阿尔茨海默(Alois Alzheimer)解剖了她已经萎缩的大脑,发现其中渗透有微小的斑块,还有奇怪的缠结标记神经元的死亡,足以将她的疾病与其他的痴呆症区分开来。它们被后世命名为β淀粉样蛋白(Aβ)和tau蛋白,成为阿尔茨海默病的独特标志物。
一百多年后,哥伦比亚安蒂奥基亚的艾丽娅(Aliria Rosa Piedrahita de Villegas)被研究人员称作“我们时代的奥古斯特”。她所在的大家庭拥有一种罕见的遗传性基因突变,几乎可以确保她在40岁左右就会罹患早发性阿尔茨海默病。然而,直到72岁,她才出现轻微的症状。2020年11月,她因黑色素瘤去世,享年77岁,离开前几个月仍记得家人和朋友、自己做饭和洗澡,并且可以毫不费力地记住“神经科学”和“冠状病毒”之类的名词。
艾丽娅究竟如何逃过了被阿尔茨海默病“诅咒”的命运,长久吸引着科学家的目光。此前他们已经通过脑核成像技术发现,她的大脑里含有大量Aβ,却没有多少tau蛋白,在普通患者中,两者往往先后出现和累加。艾丽娅的独特之处在于,她除了具有家族遗传的致病基因突变PSEN1 E280A之外,她还有一个极其罕见的基因突变——APOE3 Christchurch,且是来自父母双方的纯合子(其他人只有来自父母一方的一个基因突变拷贝)。
在APOE的3个等位基因中,APOE4被公认为阿尔茨海默病的最强风险基因,APOE2则是保护基因,而APOE3则没有特别的影响。但艾丽娅的病例显示,基因之间存在相互作用,一种罕见突变可能对抗另一种。
艾丽娅的脑部影像显示,β淀粉样蛋白与tau蛋白似乎“断绝关系”。
艾丽娅给世界留下了一个珍贵的礼物:她的大脑。借助单细胞 RNA 测序,研究人员得以揭示特定基因在脑细胞中的表达方式。最近的研究发现,她的tau蛋白病理发展,在很大程度上“放过”了对判断和其他执行功能很重要的额叶皮质,以及对记忆和学习很重要的海马体,转而涉及了枕叶皮层,即控制视觉感知的头部后部大脑区域。枕叶皮质是唯一表现出典型阿尔茨海默症特征的主要大脑区域,例如称为小胶质细胞的保护性脑细胞的慢性炎症,和降低的APOE表达水平。【1】
还有一种罕见的APOE3变体APOE3-Jacksonville,也可以降低一个人患阿尔茨海默病的风险。自2014年被报道以来,直到去年科学家才揭示它背后的潜在机制是减少APOE的自聚集,这与促进胆固醇排出和增强的脂质结合能力有关,可以降低淀粉样蛋白负荷和相关毒性,促进大脑的修复和健康老化。【2】
“对阿尔茨海默病和认知衰退有抵抗力的患者,正在引领我们对阿尔茨海默病病理生理学理解的一场革命,并为新的、受患者启发的疗法铺平道路。”麻省总医院多文化阿尔茨海默症预防项目(MAPP)主任、哈佛医学院精神病学副教授亚基尔·基罗斯(Yakeel T. Quiroz)参与领导了APOE3 Christchurch的研究。她认为,APOE3-Jacksonville与硫酸乙酰肝素蛋白聚糖的相互作用受损,可能是与认知症风险降低相关的 APOE 变体(包括 APOE3-Christchurch 和 APOE2)的共同特征,需要进一步研究。
进入基因组“暗物质”研究
早期发现的阿尔茨海默病基因,如导致早发性阿尔茨海默病的APP、PSEN1、PSEN2,和晚发性阿尔茨海默病的主要风险基因AOPE,都与加速淀粉样蛋白沉积有关。2008年,阿尔茨海默病基因研究先驱鲁道夫·坦齐(Rudolph Tanzi)的实验室,首次发现与神经炎症相关的阿尔茨海默基因CD33,它携带着小胶质细胞上受体的遗传密码。
小胶质细胞通常充当大脑的管家之一,清除神经碎片,包括斑块和缠结。5年后,坦齐和他的同事们研究发现,CD33影响小胶质细胞的活动:当该基因高度表达时,小胶质细胞会从管家转变为神经元杀手,从而引发神经炎症。此后,与CD33具有相反作用的另一个阿尔茨海默基因TREM2也被发现,它可以关闭小胶质细胞促进神经炎症的能力。
这或许能够与部分特殊病例相印证:他们在尸检中被发现脑部有大量淀粉样斑块和神经元纤维缠结,却始终没有出现阿尔茨海默病症状,原因就在于他们没有神经炎症。用坦齐的比喻来说,感染点燃了淀粉样蛋白病变的火柴,随着蛋白积累,杀死神经元,引发神经炎症,随后才蔓延为脑内的“丛林大火”。
鲁道夫·坦齐在线上演讲中,介绍神经炎症在阿尔茨海默发病机制中的重要性。
今年4月,一项迄今为止最大规模、涉及10万患者和60万健康人的全基因组关联研究结果出炉。在识别出的75个与阿尔茨海默有关的基因组区域中,新发现了42种阿尔茨海默基因,同样将阿尔茨海默病与大脑免疫系统受损联系了起来。【3】
“创建一个广泛的阿尔茨海默病风险基因列表,就像一个大型拼图过程,这项工作虽然没有为我们提供完整的画面,但给出了宝贵的框架。当然,它也告诉我们阿尔茨海默症有多么复杂,多种不同机制影响着疾病发展。”英国阿尔茨海默症研究中心的研究主任苏珊·科尔哈斯(Susan Kohlhaas)说道。
不过,仅仅有全基因组关联研究(GWAS)或许仍然不够。阿尔茨海默病的遗传力(即遗传变异占表现型总变异的百分数)估计在60%-80%之间。“APOE,APP,PSEN1和PSEN2,加上前40个GWAS基因,仅占阿尔茨海默病遗传风险的一半,剩下的另一半未知,这是我们进入基因组‘暗物质’的地方——罕见变异。”坦齐曾说到,罕见变异在人群中的发生频率低于1%,却占个体基因组变异的77%。【4】
去年4月,坦齐和同事们利用全基因组测序(WGS),发表了新发现的13 个与阿尔茨海默病有关的罕见变异基因。它们可以提供阿尔茨海默病与神经发育、突触功能(传递化学和电通讯信号的脑细胞之间的连接)和神经可塑性(神经元重组神经元的能力)之间的一些最初的遗传联系。【5】“我们相信我们已经创建了一个新模板,用于超越标准 WGS以及疾病与常见基因组变异的关联,其中你错过了疾病的大部分遗传景观。”
麻烦的是,罕见突变可能只发生在一个人或一个家庭中。 “在阿尔茨海默病测序项目中进行全基因组测序的2万人中,54% 的单核苷酸多态性仅在一个人身上看到,”斯坦福大学博士扬·勒·根(Yann Le Guen)说。如此小的样本量要如何确定与阿尔茨海默病的关联?功能多组学分析是关键策略。
罕见基因变异堪称基因组中的“暗物质”。
罕见基因变异能告诉我们什么
寻找阿尔茨海默罕见功能基因变异的研究通常分为三类:一是在已知关联基因中寻找罕见功能变异,例如错义突变、插入/缺失、剪接变体、移码和早期终止密码子等;二是系统运用全基因组测序 (WGS) 和基于全外显子组测序 (WES) 数据,来识别罕见的功能变异;三是在新的假设驱动阿尔茨海默病的候选基因中,寻找罕见功能基因变异。一些罕见的基因变异簇还可以识别疾病相关的新基因,或表明已知疾病相关蛋白的哪个域可能出现故障。
今年4月,俄亥俄州克利夫兰凯斯西储大学的研究团队,从大约5500个阿尔茨海默病例和 5000个阿尔茨海默测序项目(ADSP)对照的WES数据着手,在近21000个基因中识别出超过160万个罕见变异。再将这些变异映射到蛋白质数据库中的6000多种蛋白质结构,以及人工智能 AlphaFold 推定的近 17500 个蛋白质结构上,发现只有少数相应基因具有统计显著性的罕见基因变异簇。
随后再在一个ADSP WES独立队列中搜索这些基因变异热点,最后锁定了三个基因:除了已知的TREM2和 SORL1,还有一个全新的基因EXOC3L4。它表达一种过去知之甚少的蛋白质,预计是外囊复合物的一个组成部分,参与囊泡运输和胞吐作用。
在这项研究的分析中,这三个基因的突变数分别达到33、56和68个。在阿尔茨海默病例中,有15个EXOC3L4变体落入 C 端 Sec6 域。【6】此前研究显示,该领域内的罕见变异与阿尔茨海默病的皮质葡萄糖代谢有关。
“这项研究提出的评估罕见错义变异同时考虑其在蛋白质中的空间分布的统计方法,在阿尔茨海默病研究领域是新颖的,特别有助于聚合在空间上聚集在一起的单例。”扬·勒·根评价,这为未来的药物开发提供了信息,即应该针对蛋白质的哪个结构域会对疾病产生影响。
“目前大约有100种阿尔茨海默相关的基因变异已经被确认,其中大约一半是保护性的,一半是危险因素,其中大多数还没有被确认的功能。”坦齐认为,接下来的问题是如何评估个体的风险,许多团队正在开发多基因风险评分,“一个好的多基因风险评分,不依赖于单个基因和基因功能,而是基于基因组单个片段的遗传模式。”
“识别已确立和新的候选阿尔茨海默基因中的罕见功能变异,有望加速阿尔茨海默病遗传数据转化为有意义的生物学数据,并更好地理解阿尔茨海默病,以及如何治疗这种毁灭性的疾病。”坦齐说。
-
世界聚焦:投资3亿元,轻舟智航拟在安阳设立无人巴士产线
头条 22-09-22
-
全球快报:国家发改委:本周国家将投放今年第三批中央猪肉储备
头条 22-09-22
-
环球热推荐:河南一AA+平台公司拟发行15亿元中票,申购区间2.8%~4.0%
头条 22-09-22
-
全球热点!2021年度河南省高速公路建设项目样板工程公布,23个工程入选
头条 22-09-22
-
【环球速看料】刚刚!河南创新投资集团揭牌
头条 22-09-22
-
焦点资讯:河南昨日新增本土无症状感染者6例
头条 22-09-22
-
环球今日报丨杨德龙:美联储如期加息75个基点 美国抗通胀之路依然艰巨
头条 22-09-22
-
天天热推荐:隔夜欧美·9月22日
头条 22-09-22
-
今日播报!首家创业板公司成功登陆瑞交所 “双创”板块企业或加速赴瑞士上市
头条 22-09-22
-
每日看点! 立方风控鸟·早报(9月22日)
头条 22-09-22
-
今日快讯:皮海洲:上市公司回购如潮 为何难以提振股价?
头条 22-09-22
-
世界速讯:深夜突发!美联储宣布:加息75个基点→
头条 22-09-22
-
焦点热文:同心传动签订1.13亿元年度框架合同
头条 22-09-21
-
环球最资讯丨郑州收购首批2万套(间)存量房源用于人才公寓
头条 22-09-21
-
焦点速读:郑州通报5起依法查处涉房地产领域违法犯罪案件
头条 22-09-21
-
环球热资讯!国家发改委召开经济形势分析座谈会,能源、房地产等领域企业参会
头条 22-09-21
-
全球热头条丨立方风控鸟·晚报(9月21日)
头条 22-09-21
-
快播:全省首家!河南省科学院鹤壁分院揭牌成立
头条 22-09-21
-
天天即时看!13.11万件!2018年以来河南网络司法拍卖成交额722.37亿元
头条 22-09-21
-
【天天聚看点】洛阳城乡建设投资集团拟发行5亿元中票,申购区间2.80%~3.80%
头条 22-09-21
-
环球快报:设计河南建设工作会议召开
头条 22-09-21
-
动态焦点:360与鹤壁签订合作协议,联合成立河南数字城市安全研究院
头条 22-09-21
-
当前速递!蓝天燃气拟发行8.7亿元可转债,用于驻马店天然气管网村村通工程等项目
头条 22-09-21
-
速讯:地标农产品上行加速,河南铁棍怀山药、稻田活虾等最受欢迎
头条 22-09-21
-
全球微头条丨券商也“降息”了!部分券商将经纪业务客户存款利率下调至0.25%
头条 22-09-21
-
环球焦点!券商研究所大调研!中证协发文
头条 22-09-21
-
全球速读:光力科技二股东减持318.3万股,持股降至5%以下
头条 22-09-21
-
环球最资讯丨国庆出行又省一笔!今晚调油价加满一箱油将少花11.5元
头条 22-09-21
-
全球短讯!今起,商丘将在11家超市投放政府储备猪肉,价格公布
头条 22-09-21
-
今日快讯:山西省原副省长、省公安厅原厅长刘新云受贿、滥用职权案一审宣判
头条 22-09-21
-
焦点播报:78个项目进入决赛,第五届“绽放杯”5G应用征集大赛河南区域赛决赛启动
头条 22-09-21
-
焦点信息:总投资159.98亿元,河南2条高速公路项目主体施工图获批
头条 22-09-21
-
消息!天眼查精准描绘新经济行业全景画像 助力招商引资打好“组合拳”
头条 22-09-21
-
快看点丨河南天马新材完成发行1656.7万股新股,募资3.54亿元
头条 22-09-21
-
天天百事通!隆华科技拟回购1亿~2亿元股份,回购价不超过13元/股
头条 22-09-21
-
焦点热门:安阳:预计2025年氢能及燃料电池汽车相关产业年产值达100亿元
头条 22-09-21
-
快播:河南首台智慧储能液冷柜式产品下线
头条 22-09-21
-
观热点:汉威科技旗下基金公司完成登记,重点布局传感器产业链上下游
头条 22-09-21
-
世界今亮点!郑州入选!首批15个国家综合货运枢纽补链强链城市公示
头条 22-09-21
-
焦点精选!中国时速600公里高速磁浮交通系统首次亮相欧洲
头条 22-09-21
-
热头条丨浙江临海:购房最高补贴房价的1% 公积金贷款额度提至最高100万元
头条 22-09-21
-
世界速看:河南昨日新增本土无症状感染者8例
头条 22-09-21
-
【天天时快讯】养老金,又有新变化
头条 22-09-21
-
环球速递!隔夜欧美·9月21日
头条 22-09-21
-
当前时讯:商丘市部署专项债券项目申报工作
头条 22-09-21
-
热文:腾讯回应减持传言:没有任何规划、时间表或目标金额,有钱回购
头条 22-09-21
-
当前简讯:立方风控鸟·早报(9月21日)
头条 22-09-21
-
当前关注:城发环境:中标安阳内黄县农村生活垃圾清运项目,成交价2亿元
头条 22-09-20
-
环球观速讯丨立方风控鸟·晚报(9月20日)
头条 22-09-20
-
天天微头条丨四川省财政厅:近日有不法分子伪造公文,已向公安机关报案
头条 22-09-20
-
环球头条:郑州保交楼出台新举措:交房即发证
头条 22-09-20
-
焦点精选!新赛道!2025年规模将达703亿,“耳朵经济”传来好声音
头条 22-09-20
-
播报:河南文旅投资集团战略签约广西旅游发展集团,将在文化金融、影视文化等领域合作
头条 22-09-20
-
全球视讯!平煤股份获批注册20亿元PPN
头条 22-09-20
-
全球资讯:金融债承销费率再破“地板价” 40亿债券承销费不足2000元
头条 22-09-20
- 【环球速看料】困在时间里|寻找阿尔茨海默2022-09-22
- 深耕全域旅游赛道,萍乡武功山打出一套“组2022-09-22
- 美乐童年DIY丙烯笔,守护孩子童真童趣2022-09-22
- u盘驱动程序怎么安装?U盘万能驱动如何进行2022-09-22
- 颇具“颠覆者”实力,艾瑞泽8虽未上市,但2022-09-22
- 电脑死机按什么键恢复?电脑经常死机怎么办2022-09-22
- 台式电脑怎么看电脑配置高低?买电脑主要看2022-09-22
- 电脑插入移动硬盘参数错误打不开怎么办?移2022-09-22
- 固态硬盘4k对齐什么意思?固态硬盘分区为什2022-09-22
- 电脑系统注册表损坏怎么修复?PE修复系统步2022-09-22
- 电脑系统权限受限如何解除?电脑连接wifi显2022-09-22
- 笔记本电脑磁盘分区后怎么合并?电脑有几种2022-09-22
- u盘写保护怎么解除?u盘有写保护怎么强制格2022-09-22
- Outlook怎么安装?outlook在哪里打开?2022-09-22
- 货币基金爆仓是什么意思?货币基金看万份收2022-09-22
- 人民币汇率破7的利弊有哪些?人民币汇率破72022-09-22
- 工商银行类似余额宝的叫什么?余额宝利率和2022-09-22
- 短期小额理财有哪些方式?小额资金怎么理财2022-09-22
- 余额宝什么时候推出的?余额宝几点计算收益2022-09-22
- 中信银行信用卡的积分怎么使用?中信银行积2022-09-22
- 汽车保险第二年比第一年便宜多少?车险不出2022-09-22
- 网上银行跨行转账要手续费吗?网上银行跨行2022-09-22
- 科创50ETF是什么?科创50和科创50ETF的区别2022-09-22
- 建行龙卡信用卡额度是多少? 建行龙卡信用2022-09-22
- 什么是IPO?上市公司要多少资产可以上市?2022-09-22
- 欣旺达加码动力电池 目标要做到国内前三2022-09-22
- 马可波罗冲击IPO 坏账风险等备受关注2022-09-22
- 半年报显示:知名基金经理上半年赔了76亿元2022-09-22
- 招行首批落地 外币ESG债券回购业务2022-09-22
- 近期市场的持续调整和股价的回落 多家公司2022-09-22
精彩推荐
阅读排行
- 《河南省大数据产业发展行动计划(2022-2025)》出台 建全国领先大数据产业创新发展区
- 河南省干热岩资源研究成果达到国内领先水平
- 河南银保监局发布提示: 警惕非法“代理退保”陷阱 做到理性消费和依法维权
- 本年度河南最大规模“招聘会”即将上线!参会单位3239家
- 河南2条高速公路项目主体施工图获批 总投资159.98亿元
- 河南8月环境空气质量排名出炉 平顶山跃居第一驻马店垫底
- 2022年国家综合货运枢纽补链强链首批城市公示 郑州入选
- 冷空气又来啦!河南22日短暂升温 23日降温+大风来袭
- 前沿资讯!今评弹|任职要求写11遍“肤白貌美大长腿”,招聘岂能无底线的“皮”
- 全球看点:【视频】设计河南建设工作会议召开