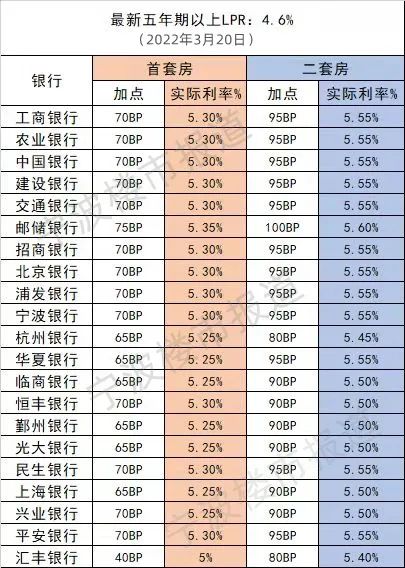
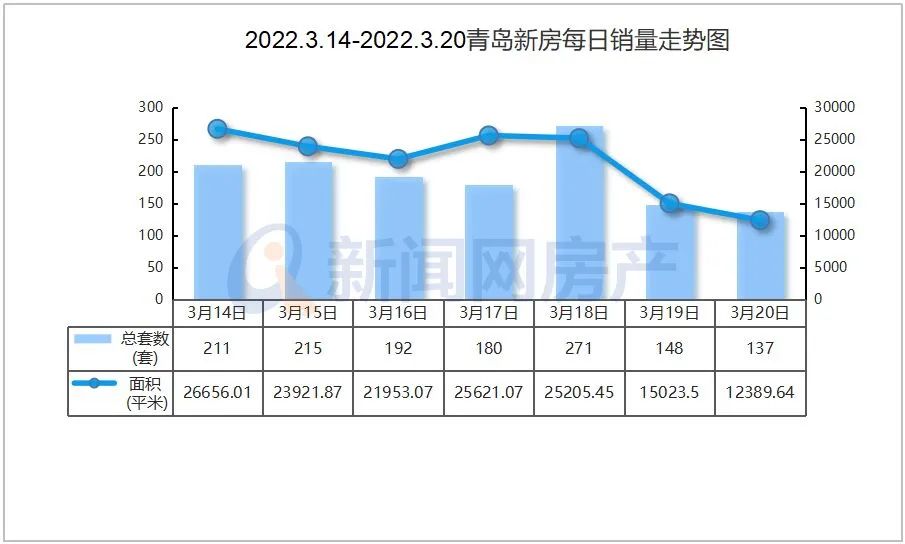
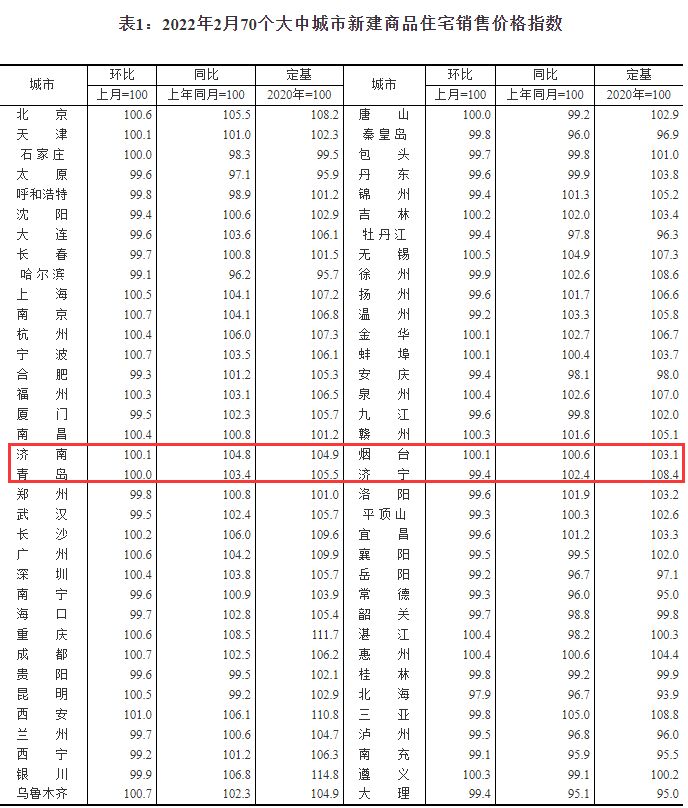
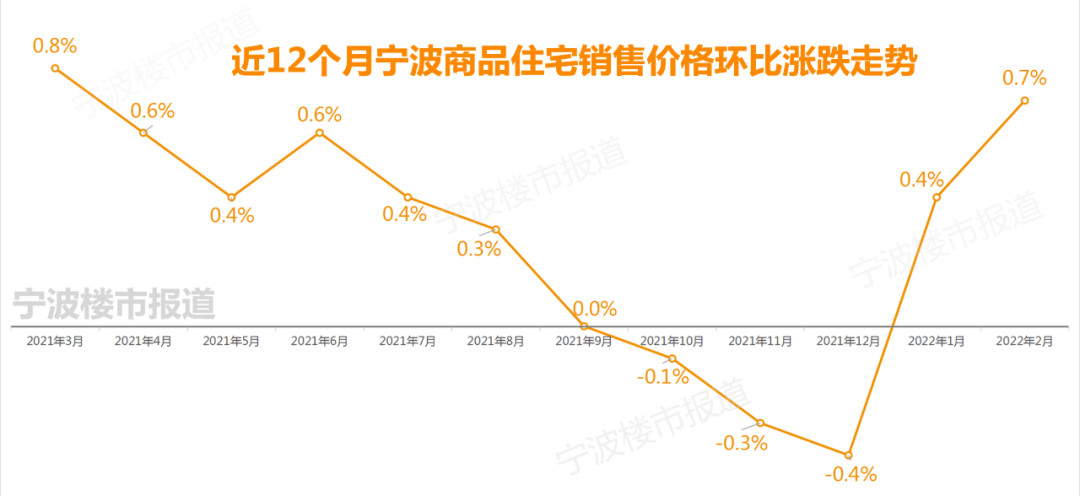
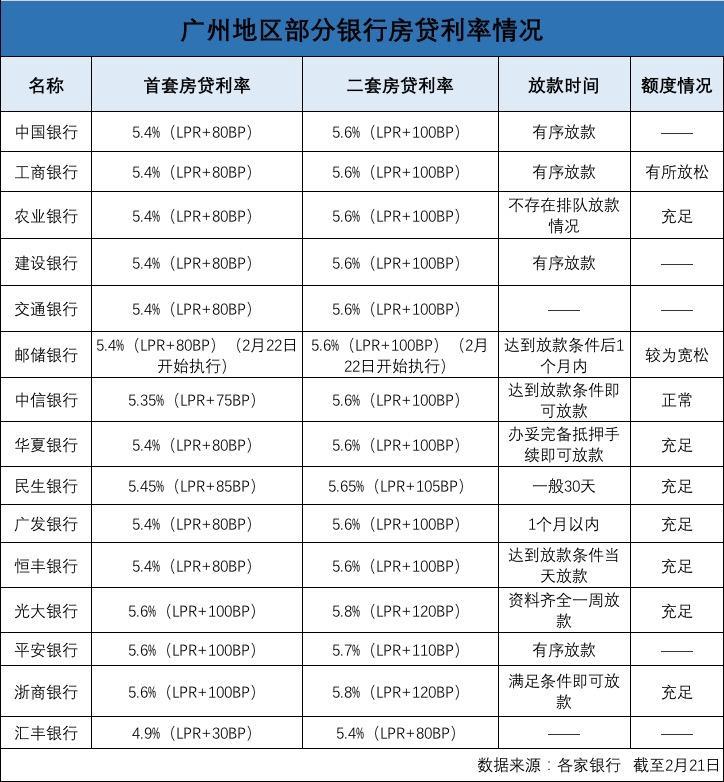
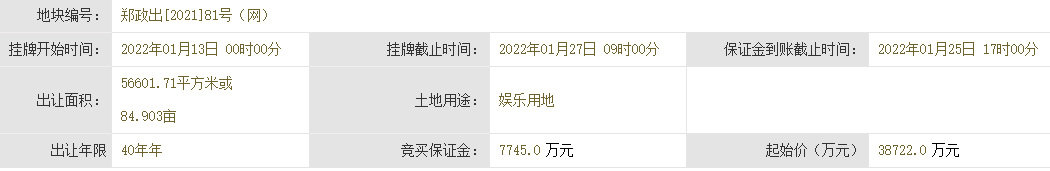
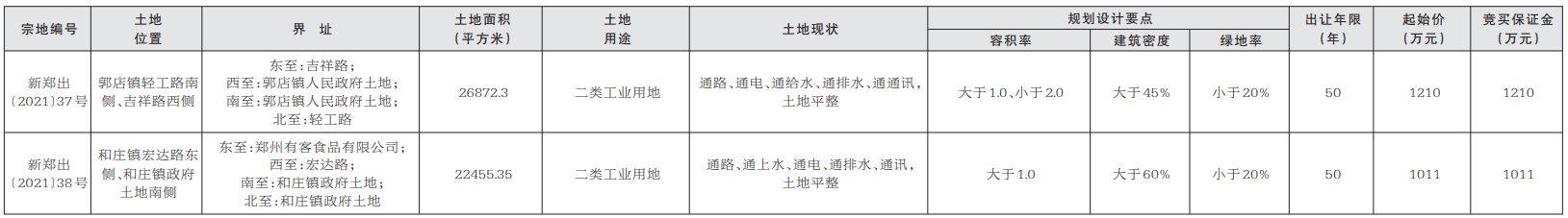
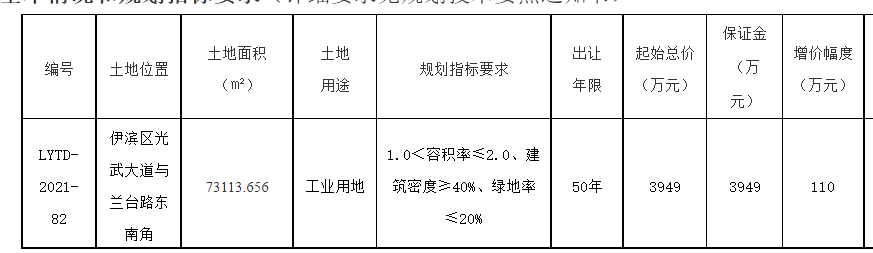
中国质量报讯 (记者 徐建华)近日,国家药监局发布《药物警戒检查指导原则》(以下简称《指导原则》),用以指导药品监管部门开展药物警戒检查工作。《指导原则》自发布之日起施行。
《指导原则》适用于省级及以上药品监管部门对药品上市许可持有人(以下简称持有人)开展的药物警戒活动进行的检查工作,对获准开展药物临床试验的药品注册申请人开展药物警戒检查的可参照实施。有关检查工作的组织实施以及检查机构和人员、跨区域检查协作等相关工作,按照《国家药监局关于印发〈药品检查管理办法(试行)〉的通知》等有关要求执行。
《指导原则》明确了药品特征、持有人特征、其他情况3个方面共14项常规检查重点考虑因素,其中药品特征包括药品的安全性特性等,持有人特征包括持有品种较多、销售量大等,其他情况包括既往药物警戒检查或其他检查情况等。有因检查重点考虑因素含8项,如对疑似药品不良反应信息迟报、瞒报、漏报,报告质量差的;未按规定或药品监管部门要求开展药品上市后安全性研究、制定并实施药物警戒计划,且未提供说明等。药物警戒检查的方式包括现场检查和远程检查,检查地点主要为持有人开展关键药物警戒活动的场所,必要时对受托开展药物警戒活动的场所进行延伸检查。
《指导原则》规定,药物警戒检查发现的缺陷分为严重缺陷、主要缺陷和一般缺陷,其风险等级依次降低。重复出现前次检查发现缺陷的,风险等级可以升级。检查项目共100项,其中可判定为严重缺陷的12项、可判定为主要缺陷的40项,其余48项可判定为一般缺陷。
《中国质量报》
【来源:中国质量报】
-
河南水投召开水工板块重组工作推进会:推进优质水工资产重组整合
头条 22-04-26
-
洛阳钼业拟发行10亿元超短融,用于偿还有息负债
头条 22-04-26
-
河南一季度重点民生实事进展情况如何?通报来了
头条 22-04-26
-
河南能源与河南理工大学签订战略合作协议
头条 22-04-26
-
如何理性投保?银保监会提醒消费者不要被“高收益”误导
头条 22-04-26
-
奇安信2021年报:营收增长39.6%,冬奥保障带动关基领域高增长
头条 22-04-26
-
紧急提醒!济源发布3例无症状感染者活动轨迹
头条 22-04-26
-
沪指跌逾1% 失守2900点
头条 22-04-26
-
商丘一季度全市生产总值727.60亿元,同比增长5.7%
头条 22-04-26
-
普惠性幼儿园比例83% 、财政投入十年增5倍……我国学前教育取得这些成就
头条 22-04-26
-
国家市场监管总局最新回应知网是否涉嫌垄断:已关注,正依法开展相关工作
头条 22-04-26
-
交通运输部:交通固定资产投资一季度同增9.8%
头条 22-04-26
-
上海严格实行“非必要不离沪” 坚决防止疫情外溢 离沪须持“双阴性”证明
头条 22-04-26
-
平顶山:支持汝州市打造河南省预制菜产业园,力争立华牧业等企业落户
头条 22-04-26
-
河南省2022年第一批13家更名高新技术企业 | 名单
头条 22-04-26
-
交通运输部:规划布局冷链物流基础设施
头条 22-04-26
-
国家卫健委:昨日本土新增1908+15816
头条 22-04-26
-
一季度全国社会物流总额84万亿元 同比增长6.2%
头条 22-04-26
-
河南省委召开新冠肺炎疫情防控工作第十六次专题会议
头条 22-04-26
-
央行开展100亿元7天期逆回购,实现公开市场零投放零回笼
头条 22-04-26
-
龙门实验室公开征集标识设计,最高奖1万元!快来投稿吧
头条 22-04-26
-
定了!2022年新乡16项重点民生实事发布,涉及就业、交通等
头条 22-04-26
-
立方风控鸟·早报(4月26日)
头条 22-04-26
-
让创新创造者没有后顾之忧!河南着力打通知识产权创造、运用、保护的服务全链条
头条 22-04-26
-
国家发改委安排5.37亿元中央资金支持河南省生态保护和修复建设
头条 22-04-26
-
河南昨日新增本土确诊病例8例,新增本土无症状感染者9例
头条 22-04-26
-
何雄会见郑州西亚斯学院理事长陈肖纯一行
头条 22-04-26
-
隔夜欧美·4月26日
头条 22-04-26
-
2800亿"强娶"有戏了?推特态度大转变,正重新考虑马斯克收购!或签订"分手费"条款
头条 22-04-26
-
全国首个!河南为进口非冷链货物贴上“行程码”
头条 22-04-26
-
上海昨日新增本土确诊病例1661例、新增本土无症状感染者15319例
头条 22-04-26
-
北京昨日本土新增“32+1”
头条 22-04-26
-
违规提供资金、年报虚假记载!河南证监局对林州重机等开出470万元罚单
头条 22-04-25
-
郑州新增1例确诊病例、2例无症状感染者 活动轨迹公布
头条 22-04-25
-
恒星科技董事长提议:最高回购1亿元股份
头条 22-04-25
-
新华网与58同城签署框架合作协议 强强合作助力高校毕业生就业
头条 22-04-25
-
捷安高科2021年营收净利双双下滑,拟申请最高8亿元授信
头条 22-04-25
-
快讯!俞建华任海关总署党委书记
头条 22-04-25
-
从事虚假点赞“生意”被快手公司索赔5000万,河南高院公布10起典型案例
头条 22-04-25
-
小豆芽一年卖出3个亿!郑州这家企业又盯上新赛道 | 豫见预制菜㉒
头条 22-04-25
-
营收净利双增!羚锐制药拟拿出近八成盈利分红2.8亿元
头条 22-04-25
-
神火股份筹划重大资产重组 股票4月26日起停牌
头条 22-04-25
-
特斯拉Q1在华收入46.5亿美元 同比增长52.8%
头条 22-04-25
-
风控鸟·晚报(4月25日)
头条 22-04-25
-
涨价能让“优爱腾”盈利吗?|立方观察
头条 22-04-25
-
每年申报3至4次,洛阳常态化开展“揭榜挂帅” 项目申报
头条 22-04-25
-
洛阳最新任免名单!韩治群任洛阳市副市长
头条 22-04-25
-
河南全省企业一季度营收9134.7亿元,同比增长14.4%
头条 22-04-25
-
央行下调金融机构外汇存款准备金率
头条 22-04-25
-
设立省级科研基金、优化科技信贷风险补偿机制 河南省财政厅全力支持科技创新
头条 22-04-25
-
面对新股破发,莫要“大惊小怪” | 立方快评
头条 22-04-25
-
8417亿元大投资,南阳2022年894个重点建设项目名单公布
头条 22-04-25
-
设研院一季度业绩双增,营收增长18.84%至3.58亿元
头条 22-04-25
-
宇通重工一季度营收7.4亿元,归母净利润8491.83万元
头条 22-04-25
-
中赟国际未完成业绩承诺,设研院将获股份、现金补偿
头条 22-04-25
- 国家药监局发布实施《药物警戒检查指导原则2022-04-26
- 消防救援大队深入红星美凯龙开展消防安全宣2022-04-26
- 「市质监站」市交通质监站组织开展“五一”2022-04-26
- 天津市发布2021年知识产权发展状况白皮书和2022-04-26
- 梦芊健康创始人谢秋英当选国医文化传承委员2022-04-26
- 北京地铁车站实现AED设备全覆盖 超4352名2022-04-26
- 《北京标准》推出89项民生服务事项 加强优2022-04-26
- 十几元钱的奶茶,冰雪时光是怎么做到好喝又2022-04-26
- 镇平县司法局枣园司法所:科学运用心理测试2022-04-26
- 南召县税务局:优化服务 为小微企业发展赋2022-04-26
- 西工区将聚焦255个重点项目 全年完成投资32022-04-26
- 彭水:畅通“黄金水道”,提升运力促发展2022-04-26
- 漯河市气象局发布大风蓝色预警「IV级/一般2022-04-26
- 辉县市气象局发布大风黄色预警「III级/较重2022-04-26
- 沁阳市气象台发布大风蓝色预警「IV级/一般2022-04-26
- 充电时自燃,新能源车被烧成空壳2022-04-26
- 冷空气扎堆,凉凉爽爽4月底!2022-04-26
- 河南一财政局领导猥亵女下属被撤职降级,受2022-04-26
- 河南水投召开水工板块重组工作推进会:推进2022-04-26
- 今后私家车新车上牌,将免查验!公安部新修2022-04-26
- 妈妈把孩子托付保姆后失联,保姆自费照顾孩2022-04-26
- 受骨骼启发 科学家开发出具有可调整刚度2022-04-26
- 餐饮寒冬季,冰雪时光为何掀起开店热潮?2022-04-26
- 工贸企业“五一”期间安全提示2022-04-26
- 山西太原公布新增确诊病例活动轨迹2022-04-26
- 26日0-12时,辽宁新增35例本土无症状感染者2022-04-26
- 推进复工复产 如何严防疫情反弹?2022-04-26
- 上海封控区全职妈妈:疫情让邻里关系更加和2022-04-26
- 来看!你身边“知识产权”2022-04-26
- 银保监会发布风险提示:正确认识人身保险新2022-04-26
精彩推荐
阅读排行
- 今后私家车新车上牌,将免查验!公安部新修订的《机动车登记规定》5月1日起实施
- 妈妈把孩子托付保姆后失联,保姆自费照顾孩子3年,孩子妈妈换了头像却不回消息?
- 一根雪糕近40块 网友:我的雪糕自由没了……
- 我们大龄打工人②丨染黑头发拒戴老花镜,只为继续有活儿干
- 注意!4月29日20时起将暂停河南省社会保障信息系统,这些业务受影响
- 河南省首批驾驶员取得C6驾照
- 俄单方面停止亚速钢铁厂作战 钢铁厂地下堪比钢筋迷宫
- 涉案金额高达200余万元!郑州经开警方打掉 一“跑分”洗钱团伙
- 4月25日河南省新增本土确诊病例8例,新增本土无症状感染者9例
- 马斯克440亿美元收购推特后是否恢复特朗普账号? 特朗普:我不会重返推特