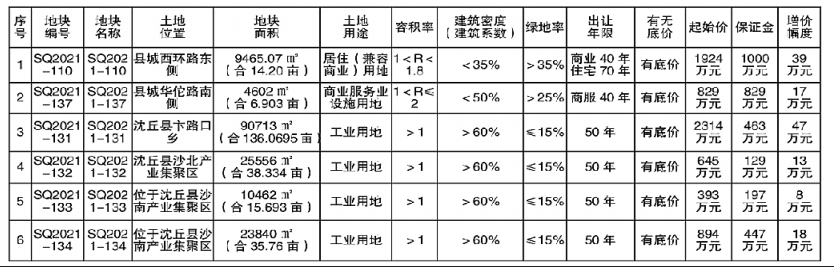
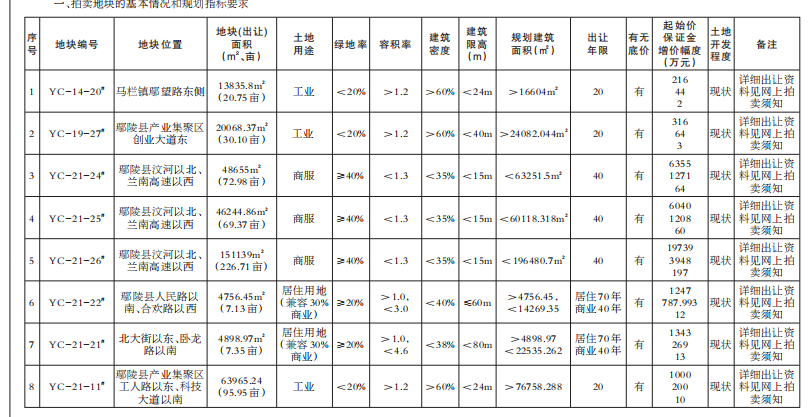
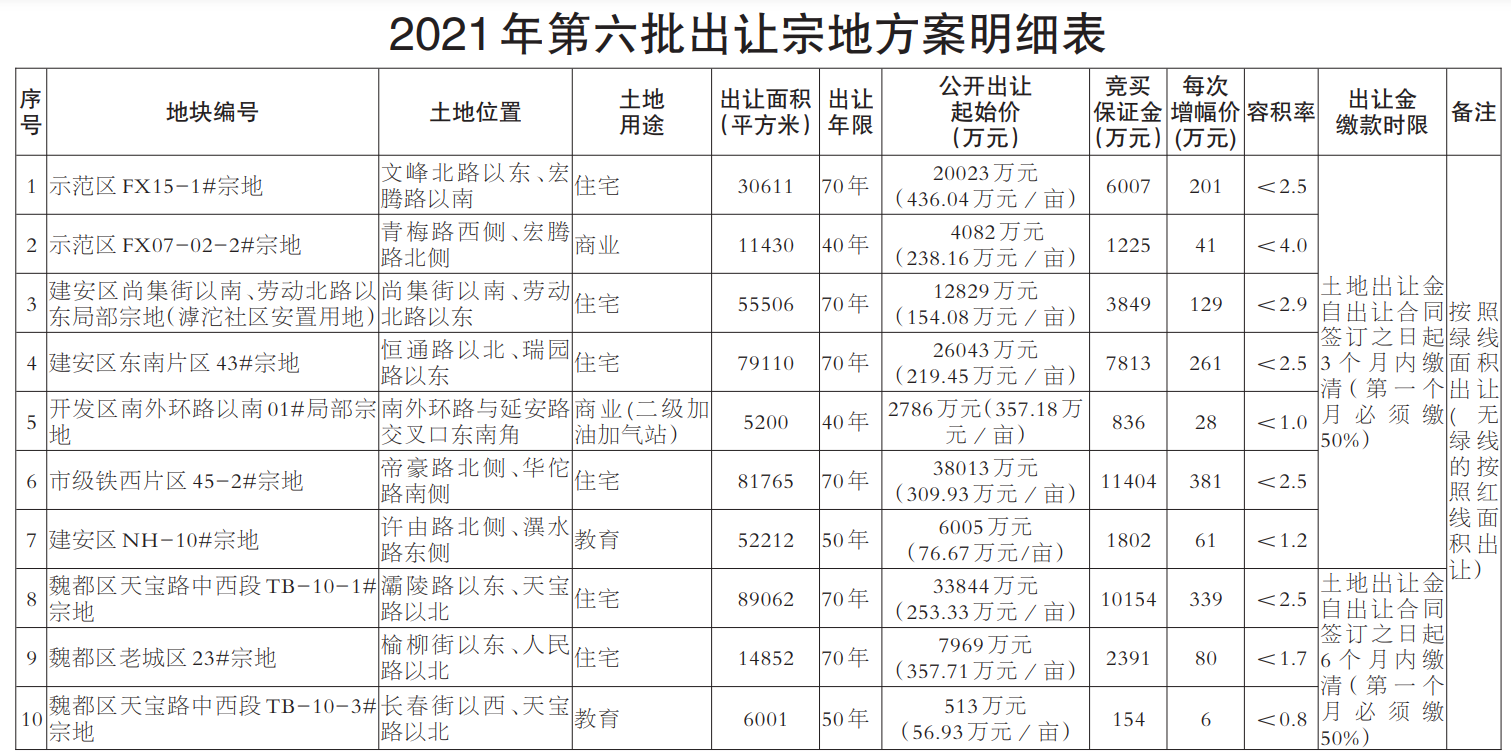
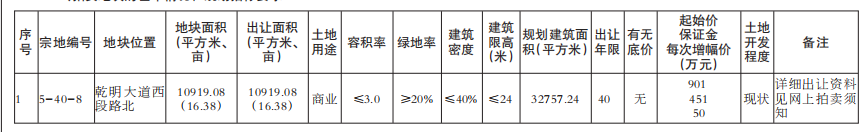
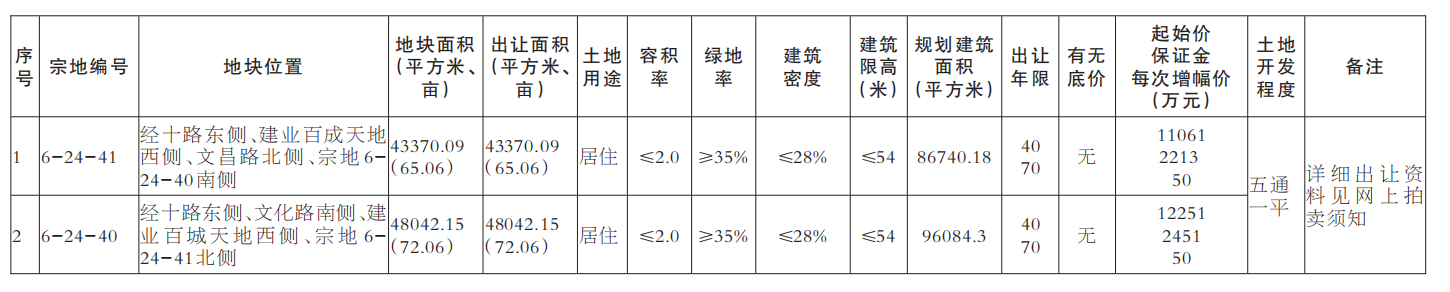
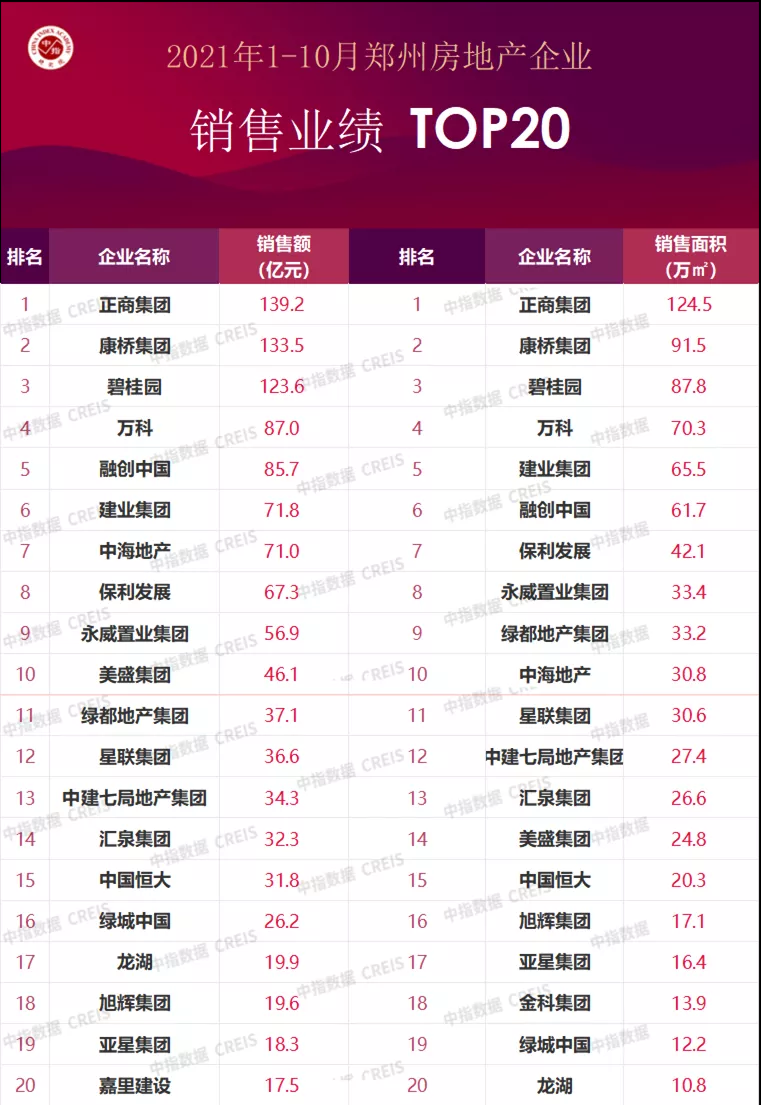
近日,国家食品药品监督管理总局、国家卫生计生委联合发布《医疗器械临床试验机构条件和备案管理办法》,明确了医疗器械临床试验机构应当具备的条件,包括具有二级甲等以上机构资质以及设置专门的临床试验管理部门、人员、管理体系等。对列入需进行临床试验审批目录的第三类医疗器械产品,应在三级甲等医疗机构专业范围内开展临床试验;开展创新医疗器械产品或需进行临床试验审批的第三类医疗器械产品临床试验的主要研究者,应具有高级技术职称并参加过3个以上医疗器械或药物临床试验。
《办法》明确,由食品药品监管总局组织建立医疗器械临床试验机构备案管理信息系统,用于临床试验机构登记备案、备案管理和供各方查询。省级以上食药监管部门和卫生计生行政部门,按照分工负责组织开展对临床试验机构的监督管理和信息沟通等监管职责。
国家食药监管总局明确,《办法》适用于在我国境内开展医疗器械(含按照医疗器械管理的体外诊断试剂产品)临床试验的机构备案管理工作,包括开展临床试验的血液中心和中心血站、设区的市级以上疾病预防控制中心、戒毒中心等非医疗机构。《办法》的颁布实施,将鼓励经评估符合条件的更多医疗机构参与医疗器械临床试验,有利于释放临床资源,扩大临床试验机构的数量,更好地满足医疗器械临床试验的需求,对鼓励医疗器械产品创新、促进医疗器械产业健康发展具有重要意义。
《办法》施行后,医疗器械临床试验机构可登录国家食药监管总局网站,在“医疗器械临床试验机构备案管理信息系统”中进行备案。有关单位和个人可通过“医疗器械临床试验机构备案管理信息系统”查询医疗器械临床试验机构备案信息。该《办法》自2018年1月1日起施行。
-
浙江杭州夫妻醉酒老公床上酣睡妻子倒挂窗外 提醒:理性饮酒安全第一
头条 22-01-21
-
美国爸爸辅导孩子写汉字气到崩溃一行字写了3小时!网友:这跟国籍无关
头条 22-01-20
-
绝望! 女子隔离14天通过监控看狗子把家拆完 网友:感到“崩溃”
头条 22-01-20
-
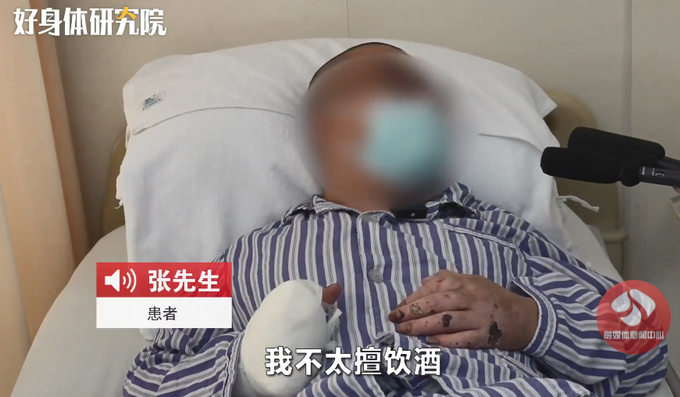
辽宁沈阳男子冬天醉卧路边冻掉4根手指!网友:多亏被人发现
头条 22-01-18
-
重庆一孕妇剪毁婚庆店内32件婚纱礼服当事人发文
头条 22-01-17
-
中国空间站与国际空间站一张对比图火了 网友直呼:画面引起舒适
头条 22-01-13
-
辟谣!800多人被拉定边沙漠去隔离?西安网警:假的!
头条 22-01-11
-
生日蛋糕上插满课本男孩崩溃大哭 妈妈:想提醒他好好复习
头条 22-01-11
-
男子地铁摸女性屁股被扇3分钟耳光?警方通报
头条 22-01-06
-
天津高速现驼鸟奔跑 官方回应:系车主运输途中不慎掉落已被车主领回
头条 22-01-05
-
长得挺特别!菠萝味草莓一斤150元 网友:直接买个菠萝吃不好吗
头条 22-01-05
-
“秦始皇”做核酸珍贵画面流出?逗乐网友!调侃:“秦始皇也要核酸了!”
头条 21-12-31
-
985大学硕士妈妈吐槽儿子是学渣:他爸气得2次心梗!以后只希望孩子健康成长
头条 21-12-31
-
查干湖“头鱼”拍出299.9999万的天价!网友:怎么吃才体现它的身价
头条 21-12-29
-
村主任用洒水车向摊位喷水?官方回应:责令其辞去村委会主任职务
头条 21-12-27
-
“外教辱骂防疫人员”,西安警方回应:已成立工作专班进行调查
头条 21-12-27
-
破防了!91岁奶奶和8岁猫咪的对话让人泪崩 网友:祝愿老人健康长寿
头条 21-12-23
-
5岁女童配合消防员教科书式自救 网友点赞:很勇敢!
头条 21-12-23
-
大爷被困电梯淡定唠嗑等救援 网友:为大爷的冷静沉着点赞!
头条 21-12-22
-
男子4万元存款18年后却被银行告知存款已被支取仅剩10块钱 法院:银行赔!
头条 21-12-20
-
深圳一男子加油站拔油枪点燃后逃跑 警方已介入调查纵火人员已锁定
头条 21-12-17
-
这位感动千万抖音网友的河南“留虾女孩” 入选央视年度短片《2021看见笑容》
头条 21-12-17
-
泪目!95岁妈妈病床前亲吻74岁生病的女儿 网友:孩子不管多大都是妈妈的宝贝
头条 21-12-15
-
川妹子抽中50颗榴莲直呼吃不完!网友:可以共享你的负担吗?
头条 21-12-15
-
河南省政府发布2022年元旦放假通知
头条 21-12-15
-
濮阳市聚碳新材料产业联盟成立
头条 21-12-15
-
周口机场预计什么时候建好?都有到哪些城市的航线?官方回复来了
头条 21-12-15
-
预计明年超50家企业回归,瑞银称中概股H股上市将继续升温
头条 21-12-15
-
新乡发现一境外输入奥密克戎病例密接者,活动轨迹公布
头条 21-12-15
-
河南:中药配方颗粒不得在医疗机构以外销售
头条 21-12-15
-
中原环保完成发行5亿元超短融,利率2.95%
头条 21-12-15
-
南阳市政府将与中车四方所在新能源装备等领域开展深入合作
头条 21-12-15
-
郑州出台新措施:公租房可“掌上”缴租秒办理
头条 21-12-15
-
国家统计局:11月社会消费品零售总额增长3.9%
头条 21-12-15
-
中国11月规上工业增加值同比增长3.8%
头条 21-12-15
-
1207万!全年就业超额完成预期目标
头条 21-12-15
-
河南凯旺科技公开发行2396万股新股,获6321.47倍申购
头条 21-12-15
-
事关货币政策、房地产、全面注册制,一行两会划定明年工作重点
头条 21-12-15
-
隔夜欧美·12月15日
头条 21-12-15
-
多部委密集部署明年工作!三大看点值得关注
头条 21-12-15
-
立方风控鸟·早报(12月15日)
头条 21-12-15
-
医药巨头今日登陆科创板!高瓴重仓"陪伴",引入"绿鞋"机制
头条 21-12-15
-
皮海洲:临门一脚踏刹车!龙竹科技终止转板说明了什么
头条 21-12-15
-
立方风控鸟·晚报(12月14日)
头条 21-12-14
-
成渝地区双城经济圈建设2022年拟推进160个重大项目,投资约2万亿元
头条 21-12-14
-
总投资额超百亿!中建七局接连中标两个EPC总承包项目
头条 21-12-14
-
2022年部分地方债提前下达,财政提前发力稳经济
头条 21-12-14
-
信阳华信投资集团10亿元中票完成发行,利率3.70%
头条 21-12-14
-
新强联拟择机出售所持明阳智能股票
头条 21-12-14
-
洛阳新强联拟亿元入股山东拟IPO公司,持股4.50%
头条 21-12-14
-
焦作在这场推介会上现场签约28个项目,总投资240亿元
头条 21-12-14
-
河南7种轻微交通违法可免罚
头条 21-12-14
-
广州高校发现古墓考古专业出动!网友:这不巧了嘛!毕业论文自己找来了
头条 21-12-14
-
浙江乐清民警自曝37岁未婚救下轻生女子 网友:一定要最爱自己
头条 21-12-14
-
画面感太强!主人出差猫咪打开水龙头把家淹了 网友:当然是原谅它
头条 21-12-09
- 现代文阅读:《掌声》阅读答案2022-01-24
- 《童年的朋友》阅读答案2022-01-24
- 苹果第三代iPhone SE前瞻 4月发布搭载A15支持5G2022-01-24
- 曝小米新旗舰有512G版 影像将是这款手机的2022-01-24
- 外星人史上最薄笔记本X14来了:RTX 3060+12022-01-24
- realmeBook增强版天青色图赏 机身厚度也是2022-01-24
- 显卡第一神软GPU-Z 2.44.0发布 支持一大2022-01-24
- AMD Zen4/Zen 4C处理器现身Linux 密度翻2022-01-24
- vivo首款平板核心规格曝光:骁龙870四边等2022-01-24
- 曝三星Tab S8系列平板国行版正在路上 内2022-01-24
- OPPO首款平板曝光 将配备11英寸的120Hz高刷屏2022-01-24
- 亚马逊不慎泄露三星Tab S8 Ultra价格 将2022-01-24
- 2021年,叫这个名字的新生儿最多!网友:似2022-01-24
- 部分地方绿码有星要隔离14天2022-01-24
- 上海卫健委: 春节期间建议市民非必要不离2022-01-24
- 上海市卫健委主任邬惊雷:建议市民非必要不2022-01-24
- 上海浦东机场各项工作目前正常开展,客运、2022-01-24
- 国家卫健委:全国累计报告接种新冠病毒疫苗2022-01-24
- 上海:为应对疫情的变化 已做好各类预案2022-01-24
- 上海:为应对疫情的变化 已做好各类预案2022-01-24
- 我国累计报告接种新冠病毒疫苗296812.1万剂次2022-01-24
- “看到他们,就像看到树朋一样……”2022-01-24
- 健康礼风靡年货节 碧然德好水送健康2022-01-24
- 陕西省延长城乡居民基本医保缴费时间至2月2022-01-24
- 安徽省组织实施2022年春风行动 鼓励企业为2022-01-24
- 重庆宋元(蒙)山城遗址考古实现新突破 天2022-01-24
- 重庆出台推动公立医院高质量发展实施方案 2022-01-24
- 海南省疾控发布春节出行防疫须知 原则上不2022-01-24
- 《甘肃省“十四五”公共服务规划》印发 将2022-01-24
- 安徽省职工疗休养政策有了新变化 职工疗休2022-01-24
精彩推荐
阅读排行
- 因冰雪恶劣天气 河南高速禁止车辆上站名单(24日9点50分发布)
- 河南再部署低温雨雪冰冻灾害天气防范应对工作 及时发布预警预报信息
- 速看!河南10部门联合发文:保障务工人员在春节期间安全有序流动
- 今年河南省公路水路计划投资1200亿元以上 新增高速公路通车里程800公里以上
- 河南确保南水北调工程“三个安全” 力争超额完成23.6亿立方米的年度供水计划
- 河南省基本养老保险参保率2025年要达 95%以上
- 注意防范!河南省气象局发布道路结冰黄色预警
- 注意!河南多地明确:全域禁售禁放烟花爆竹
- 提醒!河南省2022年上半年教师资格考试(笔试)1月24日报名
- 河南2022年启动高考综合改革 2025年第一批学生参加新高考